学术前沿丨赵虎林:运动皮层电刺激(MCS)在神经病理性疼痛中的应用
来自:学术前沿 日期:2023-11-14 10:25fMRI证实,大脑内多个皮质结构参与疼痛的调控,包括前扣带回皮质、丘脑、岛叶、额叶皮质、前运动皮质及初级运动皮层(M1)。在健康受试者或部分慢性疼痛人群中,一定强度和时长的运动锻炼或针对性的运动疗法,已被广泛验证可以有效提高疼痛阈值并改善疼痛症状。尽管对于皮层结构在调节痛觉方面的神经生物学基础,我们还所知甚少,但医学研究人员和临床专家,在初级运动皮层和缓解疼痛方面已经取得了可喜的成果,例如运动皮层电刺激(MCS)、重复经颅磁刺激(rTMS)、经颅直流电刺激(tDCS)等。
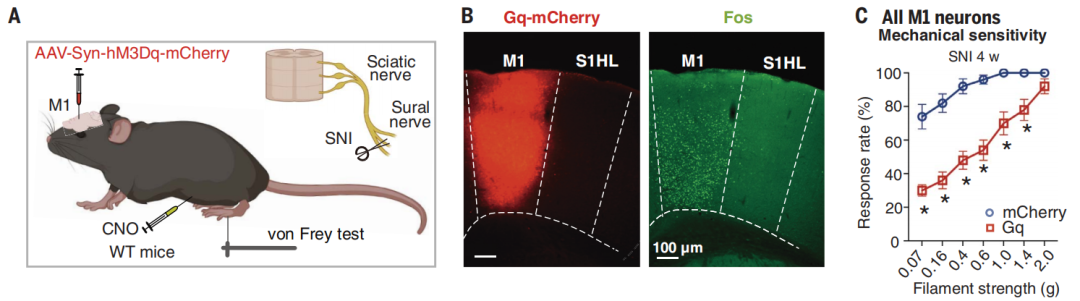
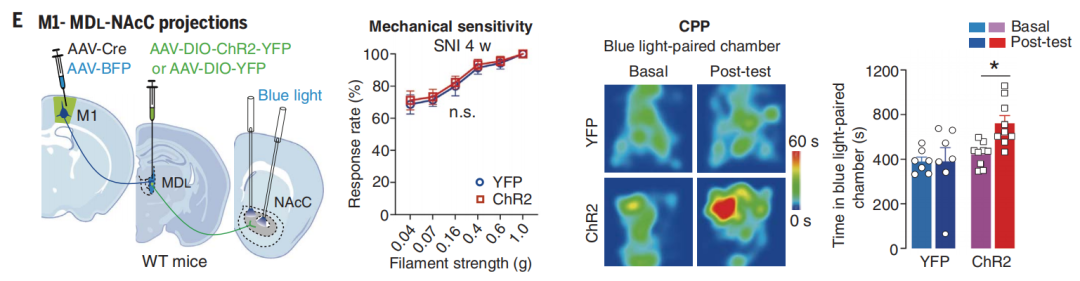
2022年12月23日,德国海德堡大学Rohini Kuner团队发表于《Science》的研究[1],首次揭示了初级运动皮层在疼痛调节中的神经环路和机制。研究表明,初级运动皮层第5层神经元投射到未定带区和导水管周围灰质的环路编码疼痛的感觉超敏信息,而初级运动皮层第6层神经元投射到中背侧丘脑、伏隔核的三级神经环路编码疼痛的负性情绪信息。激活初级运动皮层的第5层神经元后可发挥明显镇痛作用,激活第6层神经元可调控疼痛的负性情绪。该研究的发现,为神经调控疗法控制疼痛的临床实践提供了理论基础,并为改进这一疗法提供了新的见解。
运动皮层电刺激(MCS)在神经病理性疼痛中的应用已有超过30年的历史。1991年,Tsubokawa等人首次报道应用MCS治疗中枢性疼痛12例,取得了较好的疗效[2]。Tsubokawa等人尝试以MCS治疗疼痛,主要是基于动物实验发现,切断三叉神经后会出现三叉神经脊束核尾侧亚核的神经元兴奋性增强,刺激运动-感觉皮质能够抑制这种兴奋性,且刺激运动皮质比刺激感觉皮质所产生的抑制作用更强。同样,刺激脊髓丘脑束后,丘脑神经元的兴奋性也会增强,刺激运动皮质也能使其得到抑制,且比刺激感觉皮质的抑制作用更强。2010年,有学者对2名脊髓电刺激无效后改用MCS治疗有效的上肢神经病理性疼痛的患者,利用原有已植入的脊髓刺激电极作为记录电极,发现MCS电极刺激运动皮质时,能够在脊髓记录到下行的特异性波形[3]。这表明MCS的镇痛作用不在于直接刺激锥体束,而主要是电刺激在皮质下横行纤维或中间神经元传导而产生的下行抑制。
随后MCS在多种难治性神经病理性疼痛中得到应用,包括中风后中枢性疼痛、三叉神经性疼痛、臂丛神经撕脱伤和幻肢疼痛等。通过刺激与患者特定疼痛区域相对应的运动皮层区域来实现疼痛缓解。其刺激强度低于运动动作电位的阈值,可以通过硬膜下刺激和/或硬膜外刺激。
一、MCS的临床疗效
2020年的一项研究指出,目前已有文献报道的MCS例数为700,可以推测还有大量未公开报道的MCS病例。由于缺乏大型随机对照研究,不同的病例研究报告MCS的疗效存在差异。MCS治疗中枢性疼痛和三叉神经源性疼痛的相关研究更为常见。
Sindou等人回顾分析了127例MCS手术[4],发现MCS治疗的脑卒中后疼痛和三叉神经源性疼痛病人中,2/3的卒中后疼痛患者在1年随访后获得了50%的疼痛缓解,三叉神经源性疼痛患者的缓解率相似。多数患者经长期随访,缓解持续1-6年(平均2年)。
2021年一项系统回顾108例使用MCS治疗面部疼痛的患者[5],平均随访42个月,有效率为71%,面部疼痛的病因包括卒中后疼痛、三叉神经痛、特发性面部疼痛等。
MCS不仅可缓解疼痛,还可能改善患者的运动功能。2011年的一项研究中,10名患者在植入MCS后运动功能得到改善。主要的益处既不是严格的运动改善,也不是痉挛性或高张力性的改善,而是可能通过改善共济失调/本体感觉和/或局灶性肌张力障碍来改善运动的灵巧性和速度。
二、MCS疗效的预测因素
对于MCS疗效的预测因素目前尚无定论,但一些研究提供的见解可供临床参考。
2017年欧洲专家共识指出[6]:皮质脊髓束的完整性被认为是充分镇痛的必要条件。运动无力的患者疼痛减轻更少(疼痛强度评分降低15%),而无运动障碍或轻度运动障碍的患者疼痛减轻明显更好(疼痛强度评分降低73%)。
Lefaucheur等人[7]对59例在MCS前接受rTMS治疗的患者进行了一项研究。研究发现rTMS治疗有效的患者中有79%对MCS反应良好。这种相关性已在多项研究中得到证实,它似乎预测了MCS的短期和长期疗效,直接影响和改善了生活质量。然而,在经rTMS未见改善的患者中,约有30%的患者通过MCS得到改善,因此该方法的阴性预测值较低,
Yamamoto等人的研究[8],发现对氯胺酮有积极反应的患者和对吗啡有消极反应的患者将受益于MCS。
2021年Hamani等人的研究发现[9]:在没有开启刺激的情况下,7名(39%)患者在电极植入后1周即有显著的镇痛效果。这7名患者开启刺激后,术后6个月随访疼痛评分下降达到62.1%,几乎所有患者的疼痛评分下降都大于2分。研究者称该现象为“置入效应”,即置入电极但不开启刺激也能有效的患者,其远期有效率几乎为100%。
三、MCS电极定位和植入方式
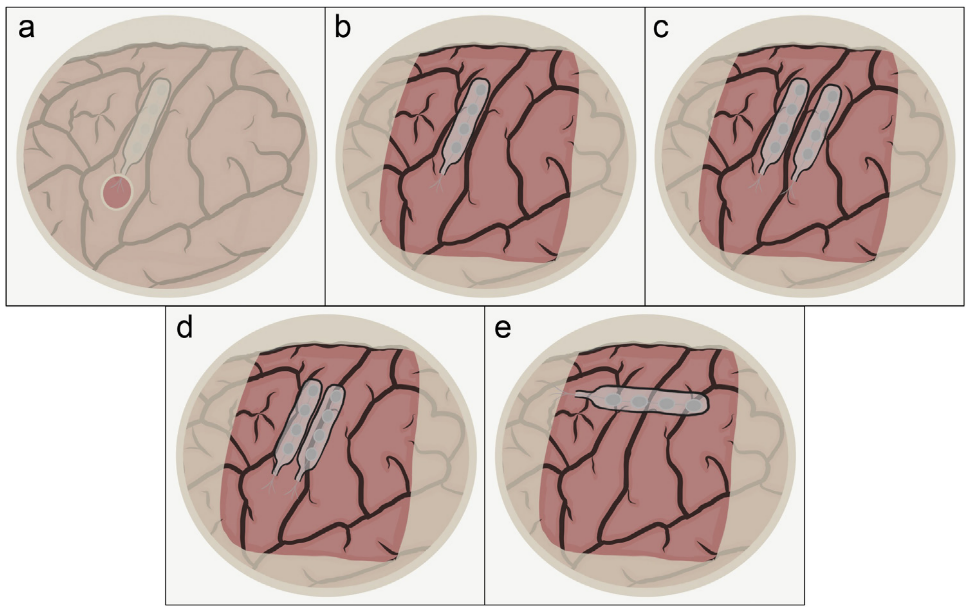
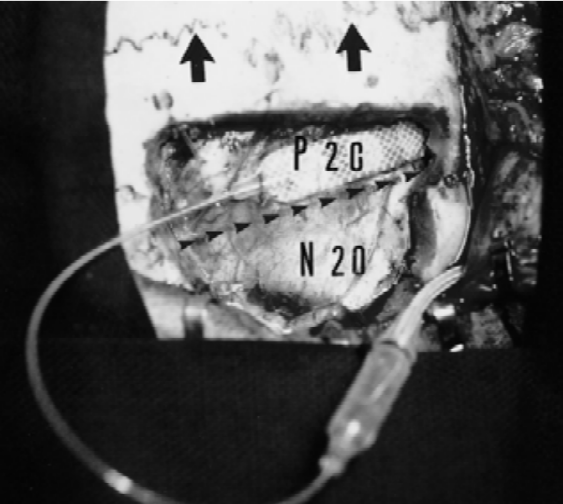
MCS刺激电极一般选择植入在疼痛对侧的运动皮质 ,术中关键问题是如何准确定位运动皮质[10]。一般结合使用以下几种常用方法,综合判断进行定位 :①立体定向框架定位。②正中神经体感诱发电位N20记录,在中央沟N20波会发生位相逆转。③功能MRI定位。④术中神经影像导航。⑤术中直接电刺激运动皮质。一般认为最后一种方法更准确且实用,全麻术中唤醒,不使用肌松剂,直接电刺激皮质,诱发对侧肢体肌肉收缩,根据肌电图监测或肉眼观察结果,从而准确判定肢体对应运动皮质的位置。术中也可将电极直接与刺激发生器连接,进行试验性电刺激。这样既可判断电极位置,同时也可测定引起对侧肢体肌肉痉挛或抽搐的刺激阈值,作为术后慢性电刺激治疗参数调试的依据,治疗所用刺激幅度一般不宜超过术中抽搐阈值的2/3,以免造成病人癫痫发作。
通常根据“皮质小人”[11],即躯体、头面部在中央前回的投影关系,选择不同的电极埋置部位和方式。然而并不是所有患者的在“皮质小人”上投影关系,都如教科书一般保持一致。一般情况下上肢或头面部疼痛,对应的是对侧中央前回的外侧凸面部分,电极一般埋置在硬膜外即可。下肢疼痛的电极应放在对侧中央前回靠近中线的对应区域,且电极多数需要深入到纵裂内才能保持与运动皮质接触良好,所以电极最好埋置到硬膜下。双侧肢体疼痛,需要在双侧中央前回埋置电极。至于电极埋置方向,通常与中央前回的方向一致,也有学者把电极与中央前回交叉跨越放置,似乎都取得了不错疗效。一般采取同期植入刺激电极和脉冲发生器;也可分期手术,一期植入刺激电极先行测试电刺激1-2周,评估有效后再二期手术植入脉冲发生器。
四、刺激参数的调整
关于参数调整目前尚无相关共识推荐,不同的研究使用的参数存在差异,不同患者的有效刺激参数也不相同。
2015年Slotty等人的研究[12],提出了一种基于运动阈值(MT)调整刺激幅度的方法。MT定义为目标肌肉发生收缩时的最低电流(或电压),MT很可能与癫痫发作阈值相似,因此应该避免高于MT的电流(或电压)。研究发现MT随患者的体位和活动水平的变化很大,本研究的MT在日常生活常用的直立坐姿状态下测量得出。研究指出虽然2Hz比50Hz更易测量MT,并且2Hz刺激不太可能导致癫痫发作,但由于不同频率下运动阈值不相同,而常规刺激采用50Hz,因此MT的测量也应在50Hz下进行。另外,MCS刺激参数的调整,患者的疼痛一般不是立即起效,平均起效时间为2.9天。研究者推荐以下编程算法:频率设置为50Hz,选择脉宽和电极配置,导致疼痛区域的运动收缩。患者应坐直,并在测试过程中激活目标的肌肉。首次电流(或电压)应设置为MT的60%,疼痛水平应监测至少一周。如果报告疼痛减轻,参数应保持不变,直到疼痛水平达到平台期(这可能需要数月),然后再进行更精细的调整。
另外有研究者报告采用周期模式(开15分钟关15分钟)[13],缓解疼痛的疗效保持不变。采用周期模式可节省电量,延长电池使用寿命,且不易产生刺激耐受。
2020年,Nussel等人的研究采用运动皮层Burst刺激模式治疗丘脑痛[14],患者在运动皮层常规刺激3个月有效的情况下,换用Burst刺激模式疼痛评分进一步下降,且随访5年疗效稳定。
MCS主要适用于脑卒中后疼痛和去传入性疼痛等神经病理性疼痛 ,具有可逆、可调节、创伤小、并发症少等优点。相对于各种破坏性止痛手术而言,MCS具有独特优势,在临床上正逐渐得到更广泛应用。
医生介绍

- 赵虎林 -
中国人民解放军总医院第一医学中心
神经外科医学部功能神经外科副主任
参考文献
参考文献:
[1] Gan Z, Gangadharan V, Liu S, et al. Layer-specific pain relief pathways originating from primary motor cortex. Science. 2022;378(6626):1336-1343.
[2] Tsubokawa T, Katayama Y, YamamotoT, Hirayama T, Koyama S. Chronic motor cortex stimulation for the treatmentof central pain. Acta Neurochir (Wein).1991; 52:137-139.
[3] Lefaucheur JP, Holsheimer J, Goujon C, Keravel Y, Nguyen JP. Descending volleys generated by efficacious epidural motor cortex stimulation in patients with chronic neuropathic pain. Exp Neurol. 2010 Jun;223(2):609-14.
[4] Sindou M P , Mertens P , Garcia-Larrea L .Surgical Procedures for Neuropathic Pain[J].Neurosurgery Quarterly, 2001, 11(1)
[5] Rapisarda A, Ioannoni E, Izzo A, Montano N. What Are the Results and the Prognostic Factors of Motor Cortex Stimulation in Patients with Facial Pain? A Systematic Review of the Literature. Eur Neurol. 2021;84(3):151-156.
[6] Kurt E, Henssen DJHA, Steegers M, et al. Motor Cortex Stimulation in Patients Suffering from Chronic Neuropathic Pain: Summary of Expert Meeting and Premeeting Questionnaire, Combined with Literature Review. World Neurosurg. 2017;108:254-263.
[7]Lefaucheur JP, Ménard-Lefaucheur I, Goujon C, Keravel Y, Nguyen JP. Predictive value of rTMS in the identification of responders to epidural motor cortex stimulation therapy for pain. J Pain. 2011;12:1102–1111.
[8] Yamamoto T, Katayama Y, Hirayama T, Tsubokawa T. Pharmacological classification of central post-stroke pain: comparison with the results of chronic motor cortex stimulation therapy. Pain. 1997;72:5–12.
[9] Hamani C, Fonoff ET, Parravano DC, et al. Motor cortex stimulation for chronic neuropathic pain: results of a double-blind randomized study. Brain. 2021;144(10):2994-3004.
[10] 胡永生,李勇杰,陶蔚,张晓华,张宇清,李建宇.运动皮质电刺激术治疗顽固性神经病理性疼痛[J].中国微侵袭神经外科杂志,2013,18(2):53-56.
[11] Gordon EM, Chauvin RJ, Van AN, et al. A somato-cognitive action network alternates with effector regions in motor cortex. Nature. 2023;617(7960):351-359.
[12] Slotty PJ, Chang S, Honey CR. Motor Threshold: A Possible Guide to Optimizing Stimulation Parameters for Motor Cortex Stimulation. Neuromodulation. 2015;18(7):566-573.
[13]Ivanishvili Z, Poologaindran A, Honey CR. Cyclization of Motor Cortex Stimulation for Neuropathic Pain: A Prospective, Randomized, Blinded Trial. Neuromodulation. 2017;20(5):497-503.
[14] Nüssel M, Hamperl M, Maslarova A, et al. Burst Motor Cortex Stimulation Evokes Sustained Suppression of Thalamic Stroke Pain: A Narrative Review and Single-Case Overview. Pain Ther. 2021;10(1):101-114.

