世界镇痛日丨“镇痛起搏器”—脊髓电刺激的发展历史及未来
来自:学术前沿 日期:2023-10-16 15:462023年10月16日是第20个“世界镇痛日”,16日-22日为中国镇痛周,本次活动主题为:提高疼痛的综合疗护能力(Integrative Pain Care)。

脊髓电刺激(SCS)用于治疗慢性疼痛已有超过50多年的历史,现已广泛应用于多种神经病理性疼痛的治疗,其疗效已经得到国内外医师认可。目前认为,对常规治疗无效的慢性疼痛病人,在充分考虑适应证和禁忌证的前提下,越早植入SCS,病人获益越大。
本文将简述SCS的历史起源、当前技术进展和未来发展方向。
脊髓电刺激(SCS)的历史和起源
从公元46年起,电就被用于治疗慢性疼痛。罗马内科医生斯克里博尼乌斯·拉格斯记载了用电鳐产生的电来治疗痛风和头痛。在19世纪末到20世纪初,发展出现代经皮神经电刺激装置的原型。1965年,罗纳德·门扎克(Ronald Melzack)和帕特里克·大卫·沃尔(Patrick David Wall)发表了他们的开创性著作《疼痛的闸门控制理论》。他们认为激活大的有髓鞘的A-β纤维可以抑制负责疼痛传导小的有髓鞘的A-δ纤维和无髓鞘的C纤维,该理论成为传统SCS的理论基础。
在闸门理论发表两年后,帕特里克·沃尔和神经外科医生威廉·斯威特发表了一个病例报告,其中8名神经性疼痛患者,采用类似于经皮神经电刺激器的电脉冲设备或通过皮下植入类似于电极的外周神经刺激器,进行电脉冲治疗。不久之后,Norman Shealy发表了一个病例报告,他采用被称为“背柱刺激”的装置治疗与支气管癌相关的顽固性疼痛。虽然该患者在手术后不久就因感染去世,但患者在去世前表示疼痛明显减轻。
随后,脊髓刺激治疗慢性神经性疼痛的临床应用呈现出指数级增长,每年大约有35000个永久植入,估计每年的市场规模为20亿美元。
美国获批的适应症
FDA批准的SCS系统适应症包括慢性顽固性腰痛和躯干、四肢疼痛,包括与FBSS相关的单侧或双侧疼痛、没有接受过脊柱手术难治性腰痛和下肢疼痛、CRPS I型和II型、糖尿病神经病变和顽固性慢性神经性疼痛(病因包括手术后、截肢后、退行性疾病和血管疾病等相关的疼痛)。
其他国家获批的适应症
在欧洲,难治性心绞痛和周围血管疾病相关的疼痛被批准为SCS的适应症。在一项大型随机对照试验中,将SCS与冠状动脉搭桥手术用于治疗难治性心绞痛进行了比较。两组患者的症状缓解程度相当。
使用SCS治疗严重肢体缺血相关的疼痛具有良好的临床效果。回顾性和前瞻性队列研究表明,当SCS与常规药物治疗联合使用时,疼痛缓解和伤口愈合优于单独药物治疗,随后的RCT研究也进一步证实了SCS的疗效。
患者选择和疗效的预测因素
患者的选择是SCS长期预后的关键。患者应是以神经病理性疼痛为主,且适当的保守治疗(通常是药物、注射和物理治疗)失败。需要对未治疗或治疗不足的精神疾病和物质滥用的患者进行心理评估,因为多达65%的慢性疼痛障碍患者存在抑郁、焦虑、物质滥用或创伤后应激障碍。研究数据表明,物质滥用、未经治疗的抑郁症与SCS不良结果相关。
一期测试手术是有必要的,以帮助临床医生确定是否需要永久植入。一般认为疼痛评分下降超过50%,则表明测试成功。然而,由于尝试不同波形刺激的时间有限,有时很难很好地了解试验是否成功,尤其是在无感觉异常刺激模式下。因此,镇痛药的减少、睡眠质量的改善和功能的增强等因素也是重要的考虑因素。
手术禁忌症包括出血、未受控制的糖尿病(HbA1C > 10)、持续吸烟或饮酒、感染和认知障碍。术前充分沟通以及患者期望值的设定至关重要,完全摆脱疼痛是不太可能的,SCS主要用于缓解疼痛和改善功能。
SCS技术的进步
①背根神经节电刺激
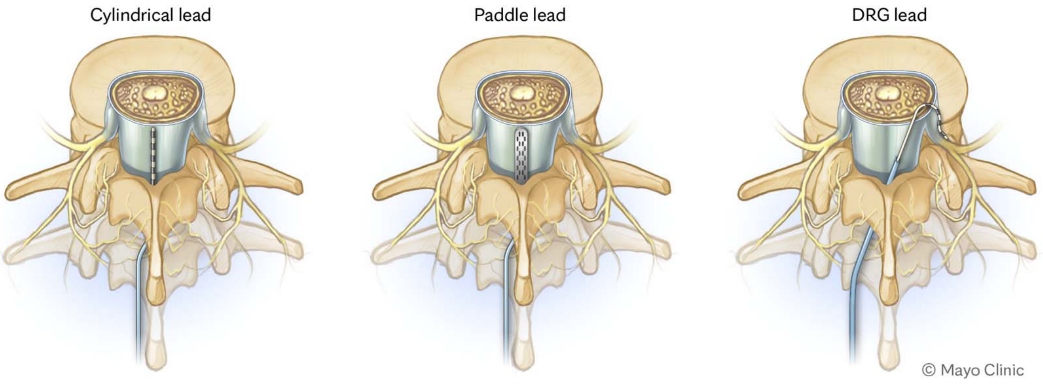
背根神经节 (dorsal root ganglion, DRG) 是感觉传导的初级神经元,在神经病理性疼痛的发生发展以及感觉异常的产生中起到关键作用。背根神经节电刺激在国外已有超过 10 年的临床应用,随着国产背根神经节刺激系统的获批上市,受到了国内临床专家的广泛关注,相信将有更多的患者从中获益。
由于DRG周围解剖位置的局限性,放置在其中的电极不易移位,可以保证电流覆盖区域和电刺激强度的稳定性。SCS优先刺激Aβ纤维,而背根神经节电刺激可同时刺激Aβ纤维、Aδ 纤维和C纤维。此外,包裹背根神经节神经元的脑脊液在局部形成一个薄凹槽,使得电流分散减少,限制了刺激信号向周围组织传递,可以给疼痛部位带来精准、稳定的麻刺感,减少了非疼痛区域的异感。此时较小的电流便可带来较好的镇痛效果,节约了电池的电量。最后,背根神经节电刺激能够在腰背部和足部等形成稳定的电流覆盖,这是SCS难以达到的。
FDA在2016年2月批准使用背根神经节电刺激,但适应证仅限于复杂性区域疼痛综合征和周围性灼痛等慢性神经病理性疼痛。因植入T10以上的安全性和有效性尚未评估,故植入的解剖区域也仅限于T10以下,包括腰椎和骶椎。但在欧洲,批准使用背根神经节电刺激无任何解剖学限制,适应证包括各种原因引起的慢性神经病理性疼痛。
近年来背根神经节电刺激已应用于多种疾病的治疗中,包括复杂性区域疼痛综合征、糖尿病周围神经病变、腹股沟区疼痛、术后疼痛、残肢痛和幻肢痛、带状疱疹后神经痛等。相关研究表明背根神经节电刺激术感染风险较低,安全性较高。
②新的刺激波形
传统的SCS疗法采用低频(
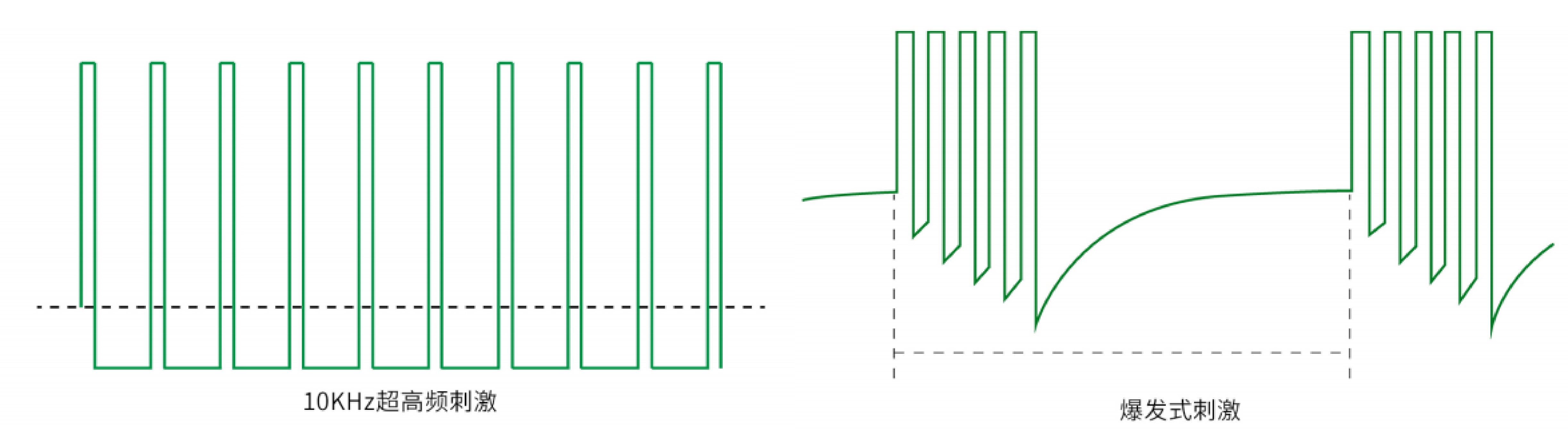
一项大型多中心随机对照试验表明,与传统SCS相比,10kHz SCS治疗慢性背痛和腿痛具有长期优势,有效率为76% vs 50%。另外在糖尿病痛性神经病变方面,10kHz SCS表现出更好的疗效。24个月的随访表明,10kHz SCS联合药物治疗疼痛评分平均下降79.9%,90.1%的患者疼痛评分下降超过50%。针对10kHz SCS和传统SCS随机对照试验的系统性综述表明,10kHz SCS的平均疼痛缓解率为73.7%,传统SCS的平均疼痛缓解率为47.5% (p
由于发现慢性神经性疼痛路径在解剖、病理生理学和临床方面与持续性耳鸣综合征有相似之处,因此展开了对脊髓进行了爆发式SCS刺激疗法的试验。De Ridder教授首次报道了爆发式SCS(Burst SCS),其波形主体为40 Hz的簇脉冲,每个簇脉冲由5个500 Hz的尖波脉冲构成,相较于传统低频 SCS,较少引起异常感觉。其机制与仅调节外侧痛觉系统的低频刺激不同,Burst刺激同时调节内侧和外侧痛觉系统,调控疼痛情绪传导通路,有助于患者转移对疼痛的注意力,达到更好的镇痛效果。在SCS测试阶段,患者先采用传统SCS模式以感觉异常覆盖的疼痛区域。随后采用Burst模式,调整幅度以找到感觉异常阈值。然后幅度降低到感觉异常阈值的80%,并进一步调整以提高患者的舒适度。SUNBURST研究比较了Burst和传统SCS,尽管两者疼痛缓解程度相似,但患者更倾向于Burst刺激。
差分目标多路复用(DTM)使用多种电信号来调节神经元和神经胶质细胞。DTM刺激的频率、脉冲宽度、电荷平衡和振幅各不相同。在腰腿痛患者中,DTM SCS的缓解率为80.1%,而传统SCS的缓解率为51.2%,且缓解持续6个月和12个月。
SCS的未来发展
①闭环脊髓电刺激
目前已获批上市的SCS均为开环系统,即以固定的振幅、频率和脉宽输出刺激。现有SCS的体位模式,可感知患者的不同体位并动态调整刺激大小,以提高患者的舒适度和疗效。一种基于ECAP(诱发复合动作电位)技术的闭环SCS系统,可以自动监测患者机体对刺激的反应,并及时调整电刺激的强度,满足不同患者需求,让患者达到最舒适状态。
②SCS新的适应症
意识障碍
近年来,SCS治疗意识障碍得到越来越多的应用。SCS通过手术放置刺激电极在颈髓C2-C4水平硬膜外正中部,电刺激通过上行性网状结构激活系统及丘脑下部激活系统传达到大脑皮层。
Kanno等人研究结果显示,纳入随访的201例持续植物状态(PVS)患者中有109例(54%)获得了良好的阳性结果。何江弘教授团队的研究发现低频刺激(如5Hz)或高频刺激(如70 Hz)都能对慢性DOC患者脑电产生积极改变,其中5Hz和70Hz频率可作为临床刺激方案的优先选择。另外何江弘教授团队回顾性分析了121名因意识障碍科接受SCS治疗的DoC患者,研究指出SCS对意识障碍(DoC)改善的总体有效率为31.8%。微意识状态(MCS) 组的有效率为64.5%,显着高于植物状态(VS/UWS )组(19.0%)。此外疗效随着年龄的增长而逐渐下降,与性别无关。脑外伤患者 (45.2%) 的效果明显好于其他的患者。在31例慢性意识障碍(pDOC)患者接受为期2周的短时程脊髓刺激治疗后,术后3个月的随访发现CRS-R评分显著升高,MCS患者从治疗中获益最大。
截瘫后康复
瑞士洛桑联邦理工学院Grégoire Courtine等人,在硬膜外电刺激(EES)帮助脊髓损伤患者恢复行走能力方面,取得了具有划时代意义的研究结果。2018年,利用电刺激靶向激活脊髓神经元的原理,团队让三名长期截瘫患者重新获得了行走的能力。2022年,团队结合人工智能软件,个性化的调控植入在患者躯干和腿部肌肉对应脊髓区域的电极。使三名完全瘫痪(ASIA A级)的脊髓损伤患者,仅仅在接受治疗后的几个小时,就恢复了独立运动能力,能够站立、行走、骑自行车、游泳和控制躯干运动。2023年,团队将大脑运动皮层的信号通过收集和转换装置输入到EES的刺激程序中,实现了大脑直接控制脊髓的中枢(腰膨大)和下肢的自主运动,使得脊髓损伤患者的行走方式更接近于自然的活动。控制信息输入到EES的程序中,来达到让大脑皮层的信息直接转化到腰髓中枢,产生自主运动,更好的促进脊髓损伤患者自主行走的日常活动。
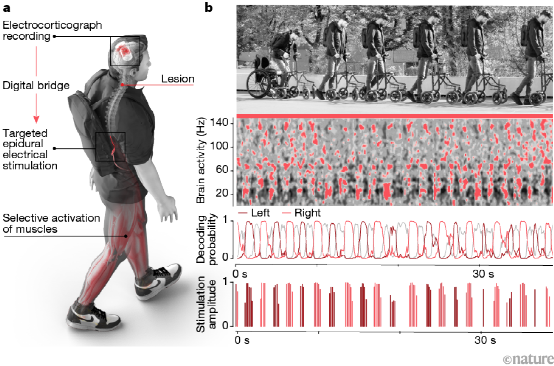
另外脊髓电刺激在体位性低血压、步态障碍等方面也取得了良好的效果,但尚需进一步的临床研究。
参考文献
参考文献:
[1] Ali R, Schwalb JM. History and Future of Spinal Cord Stimulation [published online ahead of print, 2023 Sep 8]. Neurosurgery. 2023;10.1227/neu.0000000000002654.
[2] Chapman KB, Sayed D, Lamer T, et al. Best Practices for Dorsal Root Ganglion Stimulation for Chronic Pain: Guidelines from the American Society of Pain and Neuroscience. J Pain Res. 2023;16:839-879.
[3] Lorach H, Galvez A, Spagnolo V, et al. Walking naturally after spinal cord injury using a brain-spine interface. Nature. 2023;618(7963):126-133.

