脊髓电刺激(SCS)治疗糖尿病痛性神经病变的研究进展及展望
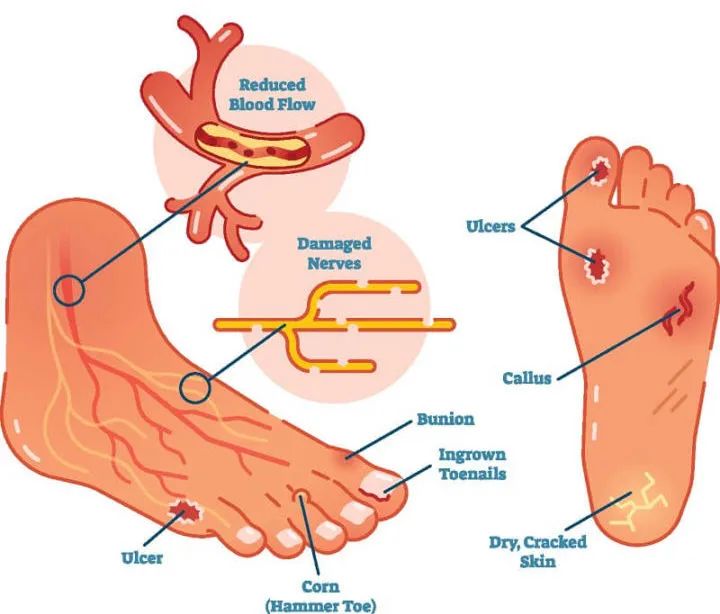
来自:学术前沿 日期:2022-11-07 14:02糖尿病周围神经病变是糖尿病患者一种常见的并发症,表现为疼痛和其他感觉障碍,包括麻木、灼烧或刺痛。当周围感觉神经病变时,由于患者对来自外部的刺激或损伤(如烫伤、冻伤、鞋源性损伤、化学性损伤、锐性刺伤及钝性损伤等)不能感知或对外伤无法察觉,因而成为导致糖尿病足溃疡的首要原因。感觉神经病变在糖尿病足溃疡发生的常见原因中列第一位。45%~60%的糖尿病足溃疡是单纯神经病变,约45%的溃疡同时兼有缺血和神经病变两种因素。
大约20%的糖尿病患者会发展为糖尿病痛性神经病变(PDN),这是一种逐渐进展的慢性神经病理性疼痛。对于糖尿病痛性神经病变的治疗是在控制血糖的基础上进行的,针对疼痛,保守治疗以药物治疗为主,临床上最常应用的药物为加巴喷丁、普瑞巴林以及阿片类镇痛药物,但镇痛效果欠佳。
脊髓电刺激(SCS)作为一种神经调控技术,已广泛应用于慢性疼痛的治疗。SCS不仅可显著缓解患者的疼痛,且可改善神经的感觉功能,近年来SCS治疗糖尿病痛性神经病变涌现出众多高质量RCT研究,下文将对脊髓电刺激(SCS)治疗糖尿病痛性神经病变研究进展进行综述,并初步展望SCS在糖尿病足中的临床应用。
01 SCS治疗糖尿病痛性神经病变
传统低频SCS(Tonic SCS)
1996年Tesfaye等人在《Lancet》发表了首个传统低频SCS治疗糖尿病痛性神经病变的对照研究[1],10例受试者中有8例进行了永久植入手术。平均随访14个月后,VAS评分从峰值8.0cm下降到2.0cm(P=0.03),并且6名完成3.3年随访的患者和4名完成7.5年的患者疼痛评分持续下降。
随着一系列前瞻性研究初步证实了传统低频SCS对于糖尿病痛性神经病变的疗效,2014年De Vos等人发表了首批多中心RCT研究[2]。该研究排除合并动脉粥样硬化和上肢糖尿病神经病变患者,共纳入了60例下肢糖尿病痛性神经病变患者,其中SCS联合药物治疗组40例,单纯药物治疗组20例。共37例(92%)患者进行了永久植入手术,电极植入位置为T9-T12之间。对两组患者随访6个月的结果显示,SCS组患者VAS评分下降了55%,而药物治疗组VAS评分未下降。
2018年,上述DeVos等人RCT研究的5年随访结果发表于糖尿病领域权威期刊《Diabetes Care》[3],22名受试者的平均疼痛评分(NRS)明显低于基线评分(-2.4分/白天,-2.1分/夜晚),与12个月的结果没有显著差异。该研究表明,传统低频SCS对于糖尿病痛性神经病变的疗效至少可持续5年。
Burst刺激
2014年一项纳入12名受试者的小型前瞻性研究[4],评估了Burst SCS对于糖尿病痛性神经病变的疗效。这些受试者之前已经平均使用传统低频SCS 1.8年,随后换为Burst模式刺激2周,患者疼痛评分平均进一步下降了1.6cm。
10kHz超高频SCS
2021年发表于《JAMA Neurology》的RCT研究[5],评估了10kHz超高频SCS在糖尿病痛性神经病变中的疗效。该研究纳入了216名受试者,是迄今为止此类研究最大规模的RCT,其中10kHz超高频SCS联合药物治疗组113名,单纯药物治疗组103名。SCS组患者均采用2根穿刺电极,通常置入在T8-T11节段,刺激频率为10kHz、脉宽30μs、幅度0.5-3.5mA。104名受试者SCS测试成功,最终90名受试者完成永久植入手术。随访6个月后,SCS组平均VAS评分从基线时的7.6厘米下降到1.7厘米,相当于78%的疼痛缓解。药物治疗组平均VAS评分从基线时的7.0 cm下降到6个月时的6.9cm,这种变化没有统计学意义。该研究还评估了受试者神经功能(包括感觉、运动和反射功能)的改善,SCS治疗组62%的受试者神经功能明显改善,而药物治疗组只有3%受试者神经功能得到改善,两组相比具有显著差异。
2022年,以上RCT研究的12个月研究结果发表于《Diabetes Care》[6]。药物治疗组95名受试者完成6个月随访,随后其中的77名转为接受SCS治疗,最终64名原本是药物治疗组的患者接受了SCS永久植入,加上原始的90名完成永久植入的受试者,总计154名受试者接受了10kHz SCS治疗。原始的90名SCS治疗组受试者,在12个月时,疼痛评分保持在1.7cm,相当于77.1%的疼痛缓解,在6个月和12个月时,86%的受试者疼痛缓解超过50%。64名交叉组的受试者,基线平均VAS评分为7.2cm,在6个月时VAS评分无变化,但在交叉后,VAS评分下降到2.0cm,达到平均70.3%的疼痛缓解、84%的治疗响应率,交叉治疗组重现了原始SCS治疗组的疗效。原始SCS治疗组68%的受试者神经感觉功能改善,而交叉治疗组也达到了62%。
一项10kHz超高频SCS治疗糖尿病痛性神经病变的真实世界研究[7],得到了类似的结果。平均随访21.8个月,79.5%的患者疼痛缓解至少50%。
背根神经节刺激(DRG-SCS)
一项小型的多中心回顾性病例研究[8],纳入了8例采用DRG电极治疗糖尿病痛性神经病变的患者,在L4-S1节段最多植入4根DRG电极。基线时VAS评分为7.4±0.7,治疗6周后,疼痛评分下降到1.5±1.3,平均疼痛评分下降79.5%±18.8%。其中2名患者疼痛完全消失,7名患者疼痛评分下降超过50%。
糖尿病痛性神经病变作为神经病理性疼痛的一种,SCS的治疗效果已得到较多高质量RCT研究的证实。其研究成果不仅在神经外科或疼痛领域期刊发表,也得到糖尿病领域权威期刊的认可。无论是传统低频刺激、Burst刺激、背根神经节刺激还是10kHz超高频刺激,SCS治疗糖尿病痛性神经病变都取得了较好的疗效。10kHz超高频SCS的治疗反应率更高,疼痛评分下降幅度更大,并观察到神经感觉功能的改善。因其无异常感觉,患者耐受性更高。美国FDA已批准10 kHz脊髓电刺激(SCS)用于治疗糖尿病痛性神经病变。
02 SCS在糖尿病足中的应用展望
世界卫生组织(WHO)将糖尿病足定义为:糖尿病患者合并神经病变及各种不同程度末梢血管病变而导致下肢感染、溃疡形成和(或)深部组织的破坏。显然对于糖尿病足的外科治疗,针对神经病变和血管病变的治疗是两个重要的环节。上文所述的高质量RCT研究,已经证实SCS不仅可以有效缓解糖尿病神经病变的疼痛,同时对于神经感觉功能的改善也有显著疗效。
糖尿病外周血管病变虽然不是引起足部溃疡的直接原因,但它却是糖尿病足溃疡发生后,迁延不愈的重要因素。糖尿病足患者因为微循环受损往往无法进行血运重建手术,腰交感神经毁损术可改善下肢血液循环从而减轻疼痛,但对于病情较重者或缺血区域缺乏侧支血管的患者疗效欠满意。SCS最早在1976年被报道用于治疗缺血性疾病,近年来国外已经广泛开展,其主要作用在于缓解疼痛和改善微循环两个方面,对下肢缺血性疾病减轻疼痛和改善微循环有显著作用。SCS能够恢复局部血流,改善患者的生活质量,减轻患者疼痛,阻止溃疡的进展,从而延缓截肢。
2011年,ESC外周血管疾病诊治指南推荐:腔内治疗无效或血管条件不适合开放性手术的下肢严重缺血患者可选择脊髓电刺激疗法(SCS)。近年来,国内学者在SCS治疗糖尿病足领域取得了可喜的成果。
2019年,中国医科大学附属盛京医院鲍民教授团队在《Brain Stimulation》杂志发表了首个SCS治疗糖尿病足坏疽的病例报道[9]。5-6-5片状电极放置于T9-T11节段,术后第一天患者的皮温、疼痛和水肿都得到改善。截止最后一次随访,患者的小腿疼痛和水肿得到完全缓解,行走能力得到提高,且脚后跟溃疡也得到愈合。左下肢的经皮氧分压(TcPO2)从2mmHg上升到35mmHg,皮温上升了2℃。
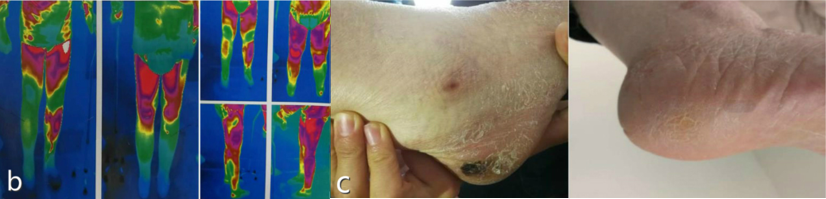
2022年,鲍民教授团队又发表了17例患者的研究[10]。与治疗前比较,治疗后1周、1个月、3个月VAS评分、匹兹堡睡眠质量指数(PSQI)评分、创面颜色评分均显著降低(P<0.01); 患者双腿和双脚皮肤温度均升高。
2021年,中国医科大学附属第一医院宋涛教授团队发表了14例SCS穿刺电极治疗糖尿病足的研究[11]。其中3例为神经型糖尿病足,无明显皮肤破溃;11例为缺血型或混合型糖尿病足,均存在不同程度的皮肤破溃或坏疽;所有患者均未进行过血运重建手术,两根8触点穿刺电极置入T8-T10节段。IPG植入后1d、1周、3个月、6个月、12个月的VAS评分由治疗前的(7.5±1.2)分降至(2.6±0.8)、(2.0±0.7)、(1.6±0.6)、(1.0±0.9)、(0.9±0.9)分,较治疗前均有显著改善(均PP2分别为(23±5)、(38±6)mmHg,差异有统计学意义(PP
SCS治疗糖尿病足,除了通过干扰疼痛在脊髓的传导来减轻疼痛,还可以改善下肢微循环,升高皮肤温度,从而促进足部创伤的愈合。其机制可能是:SCS通过干扰交感神经节的烟碱传递并抑制节后α1肾上腺素受体,来抑制交感神经传出,从而发挥扩血管的作用。SCS刺激还可激活细胞信号分子通路,导致神经末梢释放血管舒张因子,减少血管阻力和增加局部血流,并促进内皮保护和新的血管生成。测试阶段肢体末端的TcPO2和体表温度改变可反映患者的下肢血运改善情况,进而评估患者预后。有研究认为,植入测试电极后,TcPO2绝对值提高>10mmHg,或者相对值提高>20%,可预测SCS植入后能较好地改善下肢缺血。
随着更多新型植入式脊髓电刺激系统的上市,以及植入式脊髓电刺激系统的国产化,相信越来越多的糖尿病痛性神经病变和糖尿病足患者可以从中获益,临床医生也可以尝试更多的刺激模式,像10kHz超高频刺激、Burst刺激、DRG刺激等,以提高疗效。
参考文献
[1]Tesfaye S, Watt J, Benbow SJ, Pang KA, Miles J, MacFarlane IA. Electrical spinal-cord stimulation for painful diabetic peripheral neuropathy. Lancet. 1996;348(9043):1698-1701
[2]de Vos CC, Meier K, Zaalberg PB, et al. Spinal cord stimulation in patients with painful diabetic neuropathy: a multicentre randomized clinical trial. Pain. 2014;155(11):2426-2431.
[3]van Beek M, Geurts JW, Slangen R, et al. Severity of neuropathy is associated with long-term spinal cord stimulation outcome in painful diabetic peripheral neuropathy: five-year follow-up of a prospective two-center clinical trial. Diabetes Care. 2018;41(1):32-38
[4]de Vos CC, Bom MJ, Vanneste S, Lenders MW, de Ridder D. Burst spinal cord stimulation evaluated in patients with failed back surgery syndrome and painful diabetic neuropathy. Neuromodulation. 2014;17(2):152-159.
[5]Petersen EA, Stauss TG, Scowcroft JA, et al. Effect of High-frequency (10-kHz) Spinal Cord Stimulation in Patients With Painful Diabetic Neuropathy: A Randomized Clinical Trial. JAMA Neurol. 2021;78(6):687-698.
[6]Petersen EA, Stauss TG, Scowcroft JA, Brooks ES, White JL, Sills SM, Amirdelfan K, Guirguis MN, Xu J, Yu C, Nairizi A, Patterson DG, Tsoulfas KC, Creamer MJ, Galan V, Bundschu RH, Mehta ND, Sayed D, Lad SP, DiBenedetto DJ, Sethi KA, Goree JH, Bennett MT, Harrison NJ, Israel AF, Chang P, Wu PW, Argoff CE, Nasr CE, Taylor RS, Caraway DL, Mekhail NA. Durability of High-Frequency 10-kHz Spinal Cord Stimulation for Patients With Painful Diabetic Neuropathy Refractory to Conventional Treatments: 12-Month Results From a Randomized Controlled Trial. Diabetes Care. 2022 Jan 1;45(1):e3-e6.
[7]Chen JL, Hesseltine AW, Nashi SE, Sills SM, McJunkin TL, Patil S, Bharara M, Caraway DL, Brooks ES. A Real-World Analysis of High-Frequency 10 kHz Spinal Cord Stimulation for the Treatment of Painful Diabetic Peripheral Neuropathy. J Diabetes Sci Technol. 2022 Mar;16(2):282-288.
[8]Falowski S, Pope JE, Raza A. Early US Experience With Stimulation of the Dorsal Root Ganglia for the Treatment of Peripheral Neuropathy in the Lower Extremities: A Multicenter Retrospective Case Series. Neuromodulation. 2019;22(1):96-100.
[9]Gao JB, Bao M. Case report of the treatment of diabetic foot disease using spinal cord stimulation. Brain Stimul. 2019;12(3):792-793.
[10]樊梦, 鲍民, 周蓬勃,等. 外科电极植入脊髓电刺激治疗糖尿病足的临床效果[J]. 中国医科大学学报, 2022, 51(3):5.
[11]刘妍, 王秋石, 万成福,等. 脊髓电刺激治疗糖尿病足临床疗效分析[J]. 中华医学杂志, 2021, 101(43):5.

